Este artículo pertenece a la serie La Letra de Temas 2020. Postpandemia: ¿hacia dónde?
A raíz de haberse remontado el ápice de la Covid-19, Temas-Catalejo solicitó a un grupo de investigadores que examinaran el presente y la perspectiva para el resto del año cubano. Les pidió un diagnóstico elaborado, que escrutara a través de la propia pandemia, y en su significación no solo clínica, sino de salud pública, y en sus ramificaciones socioeconómicas, políticas, internacionales, subjetivas; así como hacia el futuro probable.
A diferencia de la nube de cifras, verdades recibidas, declaraciones, reportajes, que inundan los medios; de los deseos y recomendaciones dirigidas al gobierno y que pasan por análisis, tan abundantes en las redes; esta serie se orienta a calcular el presente y futuro del país, para verlo mejor, como un camino entre la política y su circunstancia.
Como es usual en Catalejo, La Letra de Temas 2020 se mantiene más abierta ante otros análisis que ante otras opiniones.
También puede interesarle leer el artículo Género y salud. ¿Nuevas lecturas en tiempos de Covid-19?
Colectivo de autores del Instituto de Medicina Tropical Pedro Kourí
En diciembre de 2019, un brote de neumonía, de causa desconocida y de evolución muchas veces mortal, hizo presencia entre personas vinculadas con un mercado de mariscos y animales vivos en la Ciudad de Wuhan, China (Yang et al, 2020). Días después, las autoridades sanitarias de aquel país informaron que el brote epidémico surgido en el citado lugar estaba producido por un nuevo coronavirus (llamados así por las espículas en forma de corona que cubren su superficie) (Hui et al, 2020). La Organización Mundial de la Salud (OMS) denominó a la desconocida enfermedad COVID-19 (del inglés Coronavirus Disease of 2019) (WHO, 2020a).
El virus de Wuhan, como primeramente se le llamó, es el resultado de la transmisión y transformación mutagénica de uno que habita en murciélagos (Andersen et al, 2020). Solo seis coronavirus habían afectado a humanos con anterioridad. Cuatro de ellos apenas llegan a causar síntomas leves, tipo resfriado común; los dos restantes ya dieron lugar a dos pandemias. En 2002-2003, el coronavirus del síndrome respiratorio agudo severo (SARS-CoV, del inglés Severe Acute Respiratory Syndrome Coronavirus) ocasionó una epidemia que alcanzó una tasa de mortalidad de 10%. En 2012, el coronavirus del síndrome respiratorio del Medio Oriente (MERS-CoV, del inglés Middle East Respiratory Syndrome Coronavirus) provocó una epidemia aún más devastadora, con un índice de mortalidad de 37% (Rabi et al, 2020).
En enero 9 de 2020, investigadores chinos describieron y compartieron la secuencia genética del nuevo coronavirus (Zhou et al, 2020a). Esta coincide en 79,5% con la de SARS CoV, por lo que, a propuesta del Comité Internacional de Taxonomía, el Virus de Wuhan fue renombrado SARS CoV-2 (Gorbalenya et al, 2020). Reconocida la nueva enfermedad e identificado su agente causal, las autoridades chinas lanzaron una intensa campaña de contención. Sin embargo, el tráfico de viajeros desde y hacia la nación asiática ya había diseminado el nuevo coronavirus y la enfermedad asociada. La amplia propagación de la COVID-19 condujo a que la OMS la reconociera como pandemia en marzo 11 de 2020 (WHO, 2020b). Convertida ya en un problema de salud mayor, con consecuencias económicas y sociales, la COVID-19 ha llegado en fatídica expansión (hacia el oeste primero, hacia el sur después) a 185 países en todos los continentes, y dejado la impronta de 9 843 073 personas infectadas y 495 760 fallecidas, a la altura de junio 28 de 2020 (WHO, 2020c).
Breves notas sobre la interacción entre SARS CoV-2 y su hospedero humano
La cascada de eventos patogénicos desatada por SARS CoV-2 comienza por su entrada a una célula del aparato respiratorio de su hospedero, complejo proceso que tiene lugar en tres pasos y que describimos brevemente a continuación.
Primeramente, la glicoproteína de una de las espículas en la superficie del virus se enlaza a la enzima convertidora de angiotensina 2, o ACE2 (del inglés angiotensin-converting enzyme dos), que es su receptor en la célula a infectar (Figura); después, la enzima serino proteasa transmembrana 2, o TMPRSS2 (del inglés transmembrane serine protease dos), también en la membrana de la célula hospedera, se une a ACE2 y la escinde en dos fragmentos, proceso en el cual la glicoproteína de la espícula se activa; y, finalmente, tiene lugar la fusión de ambos ligandos y la penetración del virus al interior de la célula en la que comenzará su replicación (Rabi et al, 2020).
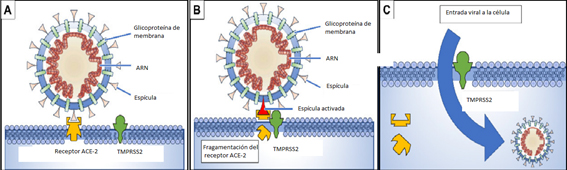
Figura.
(A) la glicoproteína de una de las espículas en la superficie del virus se enlaza al receptor ACE2 en la superficie de la célula diana;
(B) la enzima TMPRSS2 escinde a la molécula ACE2 y en ese proceso se activa la glicoproteína de la espícula;
(C) la fragmentación de ACE2 y la activación de la espícula facilitan la penetración del virus. Tomado, y parcialmente modificado, de Rabi, 2020.
Ocurrida la infección inicial, la evolución posterior de la COVID-19 es en extremo variable. Oscila entre un curso asintomático o de expresión clínica leve, lo que generalmente acontece en niños y adultos saludables, y el desarrollo de cuadros neumónicos y fallos multiorgánicos graves, más frecuentes en personas de la tercera edad y en pacientes de enfermedades crónicas. Este amplio espectro de expresión clínica es consecuencia de otro a nivel inmunológico: la infección por SARS CoV-2 activa respuestas inmunes innatas y adaptativas que, en la más frecuente y benigna de las evoluciones conducen a la contención de la replicación viral y a la recuperación, y en la más desfavorable de las secuencias pueden estimular una intensa reacción inflamatoria pulmonar que, llevando a más severas complicaciones, puede terminar en la muerte (Wang et al, 2020; Cao, 2020).
COVID-19 y edad
Sin que exista una relación estrictamente lineal, en la mayoría de los informes el riesgo de padecer de COVID-19 se incrementa con la edad (Shim et al, 2020). Como se señaló, en los niños y adultos jóvenes la infección suele ser asintomática o dar lugar a manifestaciones clínicas leves. En las personas más longevas la evolución puede ser menos favorable y, en ocasiones, dar lugar a cuadros clínicos severos.
En la totalidad de los estudios publicados sobre el tema de COVID-19 y edad, la posibilidad de fallecer por esta virosis es mayor a partir de los 60 años (Yang et al, 2020; Rabi et al, 2020; Shim et al, 2020). En Cuba, por ejemplo, a la altura del 5 de mayo de 2020, el 79,7% de los fallecidos por COVID-19 eran personas que ya habían rebasado esa edad. A ello contribuyen todos los factores relacionados con la senectud, de manera particular el padecimiento de enfermedades crónicas (las llamadas comorbilidades), que son más frecuentes a medida que se transita por las edades más avanzadas, y el envejecimiento del sistema inmune (Yang et al, 2020; Rabi et al, 2020; Shim et al, 2020; Márquez et al, 2020).
En cuanto a las comorbilidades, cuatro son las más comúnmente asociadas a la COVID-19: hipertensión arterial, enfermedades cardiovasculares, diabetes mellitus e insuficiencia respiratoria crónica (el orden de estas en cada serie depende de la población sobre la que se realizó el estudio) (Yang et al, 2020). Estas enfermedades y síndromes crónicos, en mayor o menor grado, comparten dos características que hacen a las personas que las padecen más vulnerables al desarrollo de cuadros severos de COVID-19: la presencia sostenida de un estado proinflamatorio y la incapacidad relativa de desarrollar respuestas inmunes adecuadas a una amplia variedad de agentes infecciosos (Márquez et al, 2020).
Desde una perspectiva dinámica, nuestro sistema inmune está constituido por dos ramas que, más allá de algunas superposiciones, tienen funciones diferentes: el sistema inmune innato y el adaptativo. Con el envejecimiento, ambos sufren cambios en su composición celular y en la calidad de su funcionamiento.
El sistema inmune innato es la primera línea de defensa contra los gérmenes que pueden invadirnos (por ejemplo, SARS CoV2) y la respuesta inflamatoria su principal componente. Típicamente, cuando un patógeno irrumpe en nuestros tejidos genera una respuesta inflamatoria aguda que, acumulando proteínas y células en el sitio lesionado, remueve al invasor e inicia el proceso de reparación (Rabi et al, 2020). El envejecimiento se caracteriza por una activación crónica del sistema inmune innato, lo que da lugar a un estado de inflamación permanente, que se ha dado en llamar «inflamación del envejecimiento», y que de maneras muy diversas es adverso al organismo que envejece (Fulop et al, 2018). Dicho en otras palabras, la respuesta inmune innata, que es beneficiosa en jóvenes y adultos saludables, puede convertirse en un mecanismo potencialmente perjudicial con el envejecimiento. La activación permanente de la respuesta inflamatoria en las personas longevas, que es más intensa en las del sexo masculino, ha sido relacionada con la vigorosa inflamación pulmonar que caracteriza a los casos severos de COVID-19 en esas edades.
El sistema inmune adaptativo se moviliza cuando el sistema inmune innato es insuficiente para eliminar una amenaza. Mientras la inmunidad innata actúa rápidamente mediante el reconocimiento de los microbios por sus características generales, las células protagónicas de la inmunidad adaptativa (linfocitos B y T) pueden eliminar al invasor con especificidad mediante el reconocimiento de pequeñas estructuras en esos microbios, llamadas antígenos. Después de eliminado el elemento extraño, el organismo conserva una pléyade de linfocitos B y T, llamados de “memoria”, que permiten reconocer y eliminar específica y rápidamente al microbio en caso de futuras invasiones (Rabi et al, 2020).
En cualquier etapa de la vida, para orquestar una efectiva respuesta inmune es necesario un adecuado balance y cooperación entre las respuestas innatas y adaptativas. Sin embargo, con el paso de los años, sobre todo después de la adultez media, ese balance sufre un deterioro gradual (Goronzy & Weyand, 2017; Fulop et al, 2018). En edades avanzadas, a la «inflamación del envejecimiento», consecuencia de la activación crónica de la inmunidad innata, se suma una decadencia de las funciones de la inmunidad adaptativa. Este declive, que también es más pronunciado en el sexo masculino, se caracteriza por dos limitaciones:
a) la insuficiencia para reconocer nuevas amenazas debido a la disminución del número de células nativas que puedan ser «educadas» para responder específicamente a los nuevos microbios, y
b) la incapacidad de desarrollar respuestas adecuadas debido a la sobreestimulación acumulada «de por vida», que relativamente ha «agotado» las células inmunes disponibles (Rabi et al, 2020).
La declinación de la inmunidad adaptativa en las personas longevas ha sido relacionada con la linfopenia (número reducido de linfocitos en sangre circulante), fundamentalmente de células T, que caracteriza a los casos severos de COVID-19 en esas edades (Qin, 2020).
Medicina basada en sexo y género: el caso de la Covid-19
En los párrafos que siguen, con el vocablo sexo nos estaremos refiriendo al estatus genético y biológico de los organismos XX o XY (Yurdakök, 2020) y con el término género estaremos aludiendo a los roles, características y oportunidades que, definidas por la sociedad, se consideran propias de hombres, mujeres, niños, niñas y personas con identidades no binarias (OMS, 2020).
Durante las últimas dos décadas ha crecido rápidamente el número de publicaciones sobre estudios que demuestran las influencias de sexo y género sobre la forma de presentación, evolución, diagnóstico y tratamiento de múltiples enfermedades (Yurdakök, 2020; Walter & McGregor, 2020). El creciente interés en esos aspectos es parte de un tema más general, el de la medicina de precisión, la cual aboga por que el acercamiento al estudio de cualquiera enfermedad pueda ser modificado en función de un segmento de población dado (por ejemplo, hembras o varones). En los últimos lustros, esa línea de pensamiento ha conducido a lo que hoy se conoce como medicina basada en sexo y género (SGBM, del inglés Sex and Gender Based Medicine) (Yurdakök, 2020; Walter & McGregor, 2020).
La SGBM propicia el reconocimiento de la influencia de sexo y género en el equilibrio salud-enfermedad y promueve la consideración de esas variables tanto en la investigación como en la práctica clínica. Diferencias de sexo y género han sido observadas en la evolución, diagnóstico, tratamiento y control de eventos clínicos de índole muy diversa, desde enfermedades cardiovasculares hasta lesiones deportivas (Walter & McGregor, 2020). A manera de ejemplo, ninguno mejor en el contexto del tema que nos ocupa que las epidemias de SARS (2003) y MERS (2012), las que tuvieron índices de letalidad más altos en hombres que en mujeres (21,9% y 13,2%, respectivamente) (Channappanavar et al, 2017; Matsuyama et al, 2016).
Los primeros informes sobre la epidemia de COVID-19 en China mostraban un predominio del sexo masculino entre las personas infectadas (Gebhard et al, 2020; Chen et al, 2020). Sin embargo, pasadas varias semanas desde la aparición de los primeros casos, la diferencia en las proporciones de hembras y varones entre los individuos infectados se hizo estadísticamente no significativa. El predominio masculino inicial entre las personas infectadas fue interpretado como una consecuencia del mayor número de individuos de ese sexo entre los trabajadores y asistentes al mercado de Wuhan.
En abril 30 de 2020, 35 países ya desagregaban por sexos los datos epidemiológicos de sus casos confirmados de infección por SARS CoV-2. Hasta ese día, 14 naciones informaban una mayor proporción de confirmados masculinos, 2 una incidencia similar en hembras y varones, y 19 una cuantía de infectados del sexo femenino ligeramente superior. Netamente, y tal como notificaban otros autores en datos publicados de sus respectivos países, no parecen existir diferencias de sexos en cuanto a proporciones absolutas de casos infectados (Gargaglioni & Marques, 2020). Cuba no escapa a esa consideración general y así, el pasado 28 de junio de 2020, de 2340 personas infectadas, 1162 (49,6%) eran del sexo femenino y 1178 (50,4%) del masculino (MINSAP, 2020).
En el reporte de 35 países a que hacíamos referencia, 33 naciones informaban que el número de fallecidos por COVID-19 era mucho mayor en hombres que en mujeres. Por ejemplo, en China hasta esa fecha la letalidad era de 4,7% en las personas de sexo masculino y de 2,8% en las de sexo femenino. Es decir, en el país asiático mueren por COVID-19 68% más hombres que mujeres (Gargaglioni & Marques, 2020). Cuba tampoco escapa a esa tendencia general y así, también con datos del pasado 28 de junio, la letalidad entre los hombres infectados era de 4,4% y entre las mujeres en igual condición de 3,0% (MINSAP, 2020).
Un estudio muy reciente analiza, desagregada por sexos, la información epidemiológica correspondiente al paso de la virosis por seis países (China, Italia, España, Francia, Alemania y Suiza). A partir de los casos de 227 219 personas en las que se confirmó la infección por SARS CoV-2, entre ellas 14 364 fallecidas por COVID-19, se observó un hecho extremadamente trascendente: el índice de letalidad masculino es consistentemente más alto en todos los rangos de edades (Gebhard et al, 2020). Es decir, que con independencia de que se infecten por SARS CoV-2 un número similar de hembras y varones, mueren proporcionalmente más personas del sexo masculino en todas las edades. Desde una visión más holística, ello significa que, además de las comorbilidades y la senescencia inmunológica (que generalmente ganan protagonismo después de los 60 años), factores específicos de sexo y de género, a los que hacemos referencia a continuación, también incrementan la vulnerabilidad a COVID-19.
Factores específicos de sexo en relación con COVID-19
En 1980, Pickering y Christie fueron los primeros en revelar la eficacia de los mecanismos defensivos asociados al sexo, al demostrar que los peces hembras resistían mejor los ataques por ectoparásitos que sus homólogos machos (Pickering & Christie, 1980). Durante las décadas siguientes, esas diferencias fueron corroboradas en otras especies filogenéticamente más evolucionadas. En el ratón doméstico, por ejemplo, fueron detectadas susceptibilidades dispares a la infección por SARS CoV. En condiciones de laboratorio, la tasa de letalidad en ratones machos infectados por ese virus fue de 90%, muy superior a la de 20% registrada en ratones hembras (Channappanavar et al, 2017). De ello se deduce que, al menos con respecto a las infecciones por coronavirus, los ratones muestran un dimorfismo sexual similar al de especies inferiores y al que se documenta ahora en humanos respecto a SARS CoV2 (Walter & McGregor, 2020; Gebhard et al, 2020).
Aparentemente, la disparidad entre hombres y mujeres con respecto a COVID-19 es parte de un fenómeno más general evolucionado con la reproducción biparental. Es probable que un sistema inmunitario más eficiente en vertebrados hembras (peces, ratones, humanos) pueda «conferir una ventaja de supervivencia a su descendencia», una característica que probablemente evolucionó bajo la presión selectiva de continuos ataques de microorganismos patógenos. Dado que los machos no pueden «quedar embarazados» y «convertirse en madres» no se desarrolló en ellos una «respuesta inmune optimizada» en escalas de tiempo evolutivo (Kutschera, 2020).
Las mujeres desarrollan respuestas inmunes innatas y adaptativas más fuertes que los hombres. Ese mayor vigor inmunológico tiene consecuencias positivas y negativas para ellas. De manera general, las hace más resistentes a infecciones por virus, bacterias, hongos y parásitos y, lo que no es menos interesante, mejores respondedoras a vacunas. Sin embargo, y muy en relación con su capacidad de desarrollar respuestas inmunes más vigorosas, las mujeres son más proclives a padecer de entidades clínicas relacionadas con hipersensibilidades inmunitarias, de manera particular enfermedades autoinmunes (lupus eritematoso, artritis reumatoide, entre otras) (Klein & Flanagan, 2016; Schurz et al, 2019).
En el cromosoma X se encuentra el mayor número de genes del genoma humano relacionados con la expresión y control de las respuestas inmunes (Klein & Flanagan, 2016; Jaillon et al; 2017). Las hembras poseen dos cromosomas X, y aunque un fragmento de uno de ellos se encuentra inactivado, una parte importante de esos genes logran expresarse de manera doble y proveen a las del sexo femenino de respuestas inmunes más robustas (Klein & Flanagan, 2016; Jaillon et al; 2017). Por ejemplo, el gen que codifica para la molécula TLR7 (del inglés Toll-like receptor 7) escapa a la inactivación de parte del cromosoma X, lo que resulta en una expresión doble de TLR7 en las células mononucleares de las hembras. En términos funcionales, esa mayor expresión de TLR7 se manifiesta en un incremento en la secreción de interferones, mejor reconocimiento y eliminación de virus RNA, como podría ser el caso de SARS CoV2, y en la estimulación de la producción de anticuerpos contra el virus, que en el caso de las mujeres llegan a alcanzar niveles más altos y más duraderos que los de los hombres (Pisitkun et al, 2006; Berghofer et al, 2006). Un dato muy interesante es que el gen que codifica para la molécula ACE2 también se encuentra en el cromosoma X, lo que propicia la mayor presencia de esta en las mujeres (Patel et al, 2014).
Las hormonas sexuales también contribuyen a las diferencias de respuestas inmunes entre mujeres y hombres. Los estrógenos, hormona sexual predominante en ellas, estimulan respuestas inmunes innatas y, en menor medida, adaptativas, lo cual resulta en una más rápida eliminación de patógenos y en la antes citada mayor eficacia de las vacunas en las mujeres (Klein & Flanagan, 2016; Jaillon et al; 2017). Inversamente, la testosterona, hormona sexual preponderante en ellos, tiene un efecto supresivo sobre las funciones inmunes, lo cual explica la mayor susceptibilidad a infecciones en los hombres (Klein & Flanagan, 2016; Jaillon et al; 2017). A ello se agrega que la disminución de los niveles de testosterona, tendencia característica del envejecimiento masculino, se asocia a un incremento de los niveles de citoquinas proinflamatorias (Klein & Flanagan, 2016; Rabi et al, 2020). Este hecho es uno de los factores que incrementan la severidad de COVID-19 en hombres de edad avanzada.
Más allá de su contribución a las diferencias de las respuestas inmunes entre mujeres y hombres, las hormonas tienen un mecanismo adicional para influir sobre la patogenicidad de SARS CoV-2 y la severidad de COVID-19. Se trata de la acción de estrógenos y testosterona sobre la molécula ACE2, el receptor del virus para penetrar en la célula hospedera (Gargaglioni & Marques, 2020; Manninga & Fink; 2020).
La molécula ACE2 juega un papel protector en algunos síndromes y enfermedades crónicas, como las mencionadas comorbilidades que afectan el curso de la COVID-19 (Manninga & Fink; 2020). Al utilizar a ACE2 para entrar en la célula en que se replicará, el virus disminuye la disponibilidad de la molécula en los tejidos afectados, en particular los pulmones, y ello hará más compleja la evolución clínica en los casos en que están presentes esas comorbilidades. Los estrógenos incrementan la disponibilidad de ACE2. La testosterona, en cambio, activa la enzima TMPRSS2 y con ello, además de incrementar la entrada del virus, disminuye la presencia de ACE2 (Figura). Es decir, estrógenos y testosterona, actuando de maneras opuestas sobre ACE2, pueden beneficiar o empeorar, respectivamente, el progreso clínico de la COVID-19 (Gargaglioni & Marques, 2020; Manninga & Fink; 2020).
En todos los estudios, incluso antes de la emergencia de COVID-19, las comorbilidades señaladas (hipertensión arterial, enfermedades cardiovasculares, diabetes mellitus e insuficiencia respiratoria crónica) son más frecuentes en hombres que en mujeres (Gebhard et al, 2020). Diferencias de género en cuanto a conductas de riesgo, tales como fumar e ingerir bebidas alcohólicas, que son más asiduas en hombres han sido aludidas como factores contribuyentes (Cai, 2020; Gebhard et al, 2020).
Una publicación china argumenta que, con independencia de la existencia de comorbilidades, el hábito de fumar se asocia a mayor incidencia y severidad de COVID-19 (Cai, 2020). Otro estudio, también en China, encontró que ese hábito se asociaba a una mayor presencia del receptor ACE2 en varones y con ello una mayor entrada del virus (Zhao et al, 2020). Otros no lograron confirmar esa relación causa-efecto y prefieren justificar esa asociación sobre la base de la inflamación crónica causada por el consumo de cigarrillos, que predispondría a las formas más severas de COVID-19 (Rabi et al, 2020).
Otros aspectos de género relacionados con la menor vulnerabilidad de las mujeres a COVID-19 es el de sus hábitos higiénicos y de conservación. Por ejemplos, ha sido demostrado que ellas son más dadas a lavar sus manos con frecuencia y a buscar ayuda médica cuando sienten amenazada su salud (en los casos de COVID-19 ha sido demostrado que tanto más temprano se hace el diagnóstico y se instaure tratamiento menos posibilidades de avanzar a las complicaciones severas de la enfermedad) (Cai, 2020; Gebhard et al, 2020; Zhou et al, 2020b).
A modo de epílogo
Aunque en cientos de años de práctica médica la edad ha sido reconocida como un factor de notable influencia en el curso de las enfermedades, apenas en algunos círculos académicos y en escasos segmentos asistenciales ha ganado espacio el número de profesionales que reconocen la influencia ejercida por las variables sexo y género en la forma de presentación, evolución, diagnóstico y tratamiento de todo tipo de padecimiento.
Desde una mirada global, la pandemia de COVID 19 ha evidenciado de manera inequívoca el potencial que para una eficaz práctica médica yace en un adecuado enfoque de edad, sexo y género. La prevención de la infección por SARS CoV-2 y, cuando esto no ha sido posible, el tratamiento médico de sus consecuencias, ha demostrado la necesidad de un acertado uso de esas variables. Sirvan esas demostraciones para avanzar, tanto como las circunstancias y voluntades lo permitan, hacia una medicina, además de universal y gratuita, de precisión.
Visto en perspectiva, la academia y la industria farmacéutica no deben dar la espalda a esas variables. El desarrollo de herramientas preventivas, vacunas incluidas; y procederes terapéuticos, medicamentos más eficaces entre ellos; tareas todas pendientes desde las anteriores pandemias por coronavirus, deben tener en cuentas las diferencias que introducen edad, sexo y género.
Referencias bibliográficas
Andersen, K., Rambaut, A., Lipkin, W.I., Holmes, E.C., Garry, R.F., 2020. The proximal origin of SARS-CoV-2. Nature Medicine 26, pp.450–452.
Berghofer, B., Frommer, T., Haley, G., Fink, L., Bein, G., Hackstein, H., 2006. TLR7 ligands induce higher IFN-α production in females. Journal of Immunology 177, pp.2088–2096.
Cai, H., 2020. Sex difference and smoking predisposition in patients with COVID-19. Lancet 8, 1. https://doi.org/10.1016/S2213-2600(20)30117-X
Cao, X., 2020. COVID-19: immunopathology and its implications for therapy. Nature Reviews Immunology 20, pp.269–270.
Channappanavar, R., Fett, C., Mack, M., 2017. Sex-based differences in susceptibility to severe acute respiratory syndrome coronavirus infection. Journal of Immunology 198, pp.4046–4053.
Chen, N., Zhou, M., Dong, X., 2020. Epidemiological and clinica characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 395, pp.507–513.
Fulop, T., Larbi, A., Dupuis, G., Page, A.L., Frost, E.H., Cohen, A.A., Franceschi, C., 2018. Immunosenescence and inflamm-aging as two sides of the same coin: friends or foes? Frontiers of Immunology 8, p.1960.
Gargaglioni, L.H., Marques, D.A., 2020. Let’s talk about sex in the context of COVID-19. Journal of Applied Physiology 128, pp.1533–1538. https://doi.org/10.1152/japplphysiol.00335.2020
Gebhard, C., Regitz-Zagrosek, V., Neuhauser, H.K., Morgan, R., Klein, S.L., 2020. Impact of sex and gender on COVID-19 outcomes in Europe. Biological Sex Differences 11, pp.1–13. https://doi.org/10.1186/s13293-020-00304-9
Gorbalenya, A.E., Baker, S.C., Baric, R.S., Groot, R.J. de, Drosten, C., Gulyaeva, A.A., Haagmans, B.L., Lauber, C., Leontovich, A.M., Neuman, B.W., 2020. Severe acute respiratory syndrome-related coronavirus: The species and its viruses- a statement of the Coronavirus Study Group. Microbiology.
Goronzy, J.J., Weyand, C.M., 2017. Successful and maladaptive T cell aging. Immunity 46, 364–78.
Hui, D., Madani, T., Ntoumi, F., Kock, R., O, D., 2020. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health - The latest 2019 novel coronavirus outbreak in Wuhan, China. 2020. International Journal Infection Disease 91, pp.264–266.
Jaillon, S., Berthenet, K., Garlanda, C., 2017. Sexual dimorphism in innate immunity. Clinical Reviews in Allergy & Immunology. https://doi.org/10.1007/s12016-017-8648-x
Klein, S.L., Flanagan, K.L., 2016. Sex differences in immune responses. Nature Reviews Immunology 16, 626–638. https://doi.org/10.1038/nri.2016.90
Kutschera, U., 2020. Gender-specific Coronavirus-infections in the light of evolution. Science 367, pp.1–3.
Lu, R., Zhao, X., Li, J., Niu, P., Yang, B., Wu, H., 2020. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet 395, pp.565–574.
Manninga, J.T., Fink, B., 2020. COVID-19: Digit ratio (2D:4D) and sex differences in national case fatality rates. Early Human Development 146, p.105074. https://doi.org/10.1016/j.earlhumdev.2020.105074
Márquez, E.J., Trowbridge, J.J., Kuchel, G.A., Banchereau, J., Ucar, D., 2020. The lethal sex gap: COVID-19. Immunity & Ageing 17, 1–8. https://doi.org/10.1186/s12979-020-00183-z
Matsuyama, R., Nishiura, H., Kutsuna, S., 2016. Clinical determinants of the severity of Middle East respiratory syndrome (MERS): a systematic review and meta-analysis. BMC Public Health 1203.
MINSAP, 2020. Coronavirus en Cuba. Información oficial del Ministerio de Salud Pública. Junio 28 de 2020.
OMS, 2020. Género. https://www.who.int/health-topics/genero
Patel, S., Velkoska, E., Freeman, M., 2014. From gene to proteinexperimental and clinical studies of ACE2 in blood pressure control and arterial hypertension. Frontiers in Physiology 5 (227).
Pickering, L.A.D., Christie, P., 1980. Sexual differences in the incidence and severity of ectoparasitic infestation of the brown trout, Salmo trutta. Journal Fish Biology 16, pp.669–683. https://doi.org/10.1111/j.1095-8649.1980.tb03746.x
Pisitkun, P., 2006. Autoreactive B cell responses to RNA-related antigens due to TLR7 gene duplication. Science 312, pp.1669–1672.
Qin, C., Zhou, L., Hu, Z., Zhang, S., Yang, S., Tao, Y., Xie, C., Ma, K., Shang, K., Wang, W., 2020. Dysregulation of immune response in patients with COVID-19 in Wuhan, China. Clinical Infectious Diseases. https://doi.org/10.1093/cid/ciaa248
Rabi, F.A., Zoubi, M.S.A., Kasasbeh, G.A., Salameh, D.M., Al-Nasser, A.D., 2020. SARS-CoV-2 and coronavirus disease 2019: what we know so far. Pathogens 9, pp.1–14. https://doi.org/10.3390/pathogens9030231
Schurz, H., Salie, M., Tromp, G., 2019. The X chromosome and sex specific effects in infectious disease susceptibility. Human Genomics 13, pp.1–2.
Shim, E., Mizumoto, K., Choi, W., Chowell, G., 2020. Estimating the risk of COVID-19 death during the course of the outbreak in Korea, February- 1 March, 2020 Case fatality of COVID-19 in Korea 3. Journal of Clinical Medicine 9, 1641. https://doi.org/10.1101/2020.03.30.20048264
Walter, L.A., McGregor, A.J., 2020. Sex- and gender-specific observations and implications for COVID-19. Western Journal of Emergency Medicine 21, p.507. https://doi.org/10.5811/westjem.2020.4.47536
Wang, Y., Wang, Y., Chen, Y., Qin, Q., 2020. Unique epidemiological and clinical features of the emerging 2019 novel coronavirus pneumonia (COVID-19) implicate special control measures. Journal of Medical Virology 92, pp.568–576.
WHO, 2020a. Coronavirus press conference 11 February, 2020.
WHO, 2020b. Virtual press conference on COVID-19 – 11 March 2020.
WHO, 2020c. Coronavirus disease 2019 (COVID-19): Situation report-160. Jun 28. World Health Organization, Geneva.
Yang, J., Zheng, Y., Gou, X., Pu, K., Chen, Z., Guo, Q., Ji, R., Wang, H., Wang, Y., Zhou, Y., 2020. Prevalence of comorbidities in the novel Wuhan coronavirus (COVID-19) infection: a systematic review and meta-analysis. International Journal Infection Disease 94, pp.91–95. https://doi.org/10.1016/j.ijid.2020.03.017
Yurdakök, M., 2020. Sex- and gender-based edicine in pediatrics. Journal of Pediatric and Neonatal Individualized Medicine 9, e090125. https://doi.org/10.7363/090125
Zhao, Y., Zhao, Z., Wang, Y., Zhou, Y., Ma, Y., Zuo, W., 2020. Single-cell RNA expression profiling of ACE2, the putative receptor of Wuhan 2019-nCov. https://doi.org/10.1101/2020.01.26.919985
Zhou, P., L.Yang, X., Wang, X.G., B.Hu, Zhang, L., Zang, W., Si, H.R., Zhu, Y., Li, B., Huang, C.L., 2020a. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579, pp.270–273.
Zhou, F., Yu, T., Du, R., Fan, G., Liu, Y., and Liu, Z., 2020b. Clinical course and risk factors for mortality of adult inpatients with Covid-19 in Wuhan, China: a retrospective cohort study. Lancet 395, pp.1054–1062.





7 de Julio de 2020 a las 15:32
Execente trabajo el de mis colegas. Un enfoque original cien por cien cientifico. Profundo y a la vez capaz de ser entendido por aquellos que no son del gremio. De corazon los felicito y a la revista por unir la ciencia , la cultura y promover la polémica, que es la mejor manera de desarrollar el pensamiento.
Deje un comentario